Bij de ontwikkeling van nieuwe medische producten of software komt veel kijken. De ontwikkelaars van de CE tool (Panton, Holland Innovative en Fris & Fruitig) hebben niet alleen veel kennis van CE regelgeving maar kunnen u ook helpen bij andere delen van de ontwikkeling.
Neem gerust eens contact op met een van onze experts om te bespreken wat ze voor u kunnen betekenen.


Gebruiksgemak is een belangrijke succesfactor voor de acceptatie van nieuwe technologie. Zorgtechnologie moet eenvoudig in gebruik zijn voor alle doelgroepen en passen in het werk- en zorgproces. De ontwerpers van Panton zijn erin gespecialiseerd technologie vorm te geven op een manier dat deze omarmd wordt door patiënten en zorgverleners. Ze kunnen u helpen bij de ontwikkeling van de look & feel van nieuwe producten alsook bij de technische ontwikkeling van uw producten. Dit alles binnen de kaders van de geldende CE regelgeving.
Wilt u weten hoe wij kunnen ondersteunen bij de ontwikkeling van uw nieuwe technologie, zodanig dat patiënten en zorgverleners niets anders dan uw technologie willen gebruiken? Neem eens een kijkje op de website van Panton voor inspirerende voorbeelden of neem contact op met Mario de Zeeuw.


Om ervoor te zorgen dat medische producten veilig en betrouwbaar zijn schrijft de medische wetgeving voor dat fabrikanten een kwaliteitsmanagementsysteem volgens de ISO 13485 moeten hebben. De QA/RA specialisten van Holland Innovative hebben jarenlange ervaring met het op maat maken van kwaliteitsmanagementsystemen voor makers van medische producten. Een kleine startup heeft immers hele andere behoeften dan een MKB of multinational. Ons HI-basis QMS bestaat uit pragmatische procedures en templates die al tientallen ISO13485 audits onder de MDR en IVDR ondergaan hebben. Wij kunnen het QMS bij u implementeren, uw kwaliteitsmanager opleiden, en het team trainen in het gebruik van het QMS, zodat al uw medische producten van constante en hoge kwaliteit zijn. Ons doel is om een pragmatisch, werkbaar QMS voor iedere organisatie te bouwen!
Wilt u weten hoe wij kunnen ondersteunen bij het opzetten en implementeren van uw kwaliteitsmanagementsysteem? Neem eens een kijkje op de website van Holland Innovative of neem contact op met Lisette van Steinvoren.


Steeds meer hulpmiddelen die gebruikt worden in de gezondheidszorg bevatten software of bestaan enkel nog maar uit software. Dit geldt zowel voor specialistisch medische hulpmiddelen als voor hulpmiddelen die patiënten gebruiken om (thuis) hun gezondheid te monitoren of om gezond gedrag te stimuleren. Een eenvoudig en vriendelijk te gebruiken gebruikersinterface (UX) is hierbij van groot belang. De ontwerpers van Panton zijn erin gespecialiseerd gebruikersinterfaces te ontwerpen die aansluiten bij de behoeftes en mogelijkheden van verschillende doelgroepen. Een gebruikersinterface voor hoogopgeleide medische professionals vraagt immers andere oplossingen en vormgeving dan een gebruikersinterface voor minder digitaal vaardige ouderen. Wij ondersteunen u bij de ontwikkeling van een gebruikersinterface die past bij uw doelgroep en voldoet aan de medische CE regelgeving.
Wilt u weten hoe wij kunnen ondersteunen bij de ontwikkeling van medische software of gezondheidsapps, zodanig dat deze is afgestemd op uw doelgroep? Neem eens een kijkje op de website van Panton voor inspirerende voorbeelden of neem contact op met Mario de Zeeuw.

Klinische studies zijn noodzakelijk om de veiligheid en functionaliteit van medische hulpmiddelen in een échte klinische omgeving aan te tonen. Omdat de veiligheid van het product nog niet bewezen is, maar er wel mensen blootgesteld gaan worden aan het product, moet een fabrikant aan veel regels voldoen voordat hij een klinische studie mag starten. Er moet vaak goedkeuring gevraagd worden aan een METC, en alle benodigde documentatie daarvoor moet opgesteld worden. Binnen Holland Innovative hebben wij BROK-gecertificeerde QA/RA managers die u kunnen ondersteunen in het opzetten van uw klinische studie zodat deze voldoet aan alle eisen van de wet.
Wilt u weten hoe wij kunnen ondersteunen bij het opzetten uw klinische studies? Neem dan contact op met Monique van Lier.

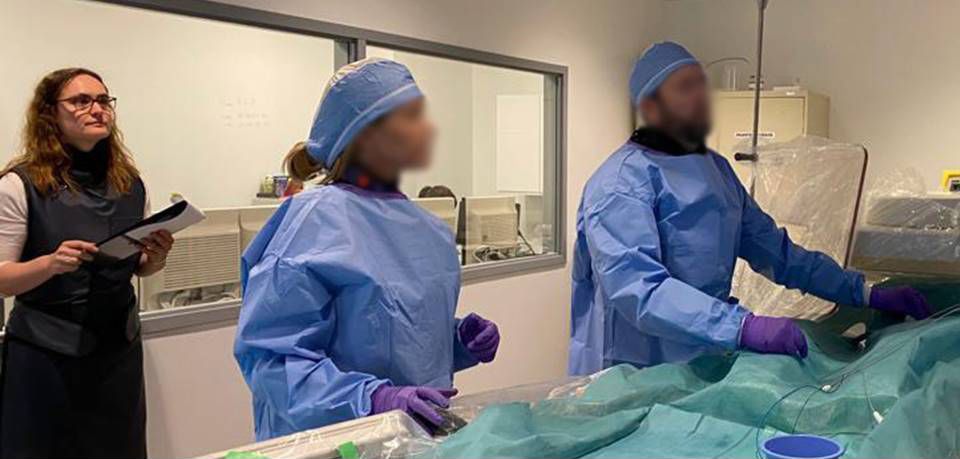
De MDR schrijft voor dat een medisch hulpmiddel veilig moet zijn, onder andere tijdens het gebruik. Om hieraan te voldoen kan de norm voor usability engineering, IEC 62366, gebruikt worden. Deze norm schrijft voor dat er usability evaluaties gedaan moeten worden.
Formatieve en summatieve evaluaties kunnen opgezet en uitgevoerd worden volgens deze norm. De ontwerpers van Panton hebben zeer veel ervaring met het opzetten, uitvoeren en documenteren van usability studies. Ze kunnen u zelfs helpen met het inrichten van de usability engineering procedures binnen uw organisatie om de usability engineering binnen al uw ontwikkeltrajecten te borgen.
Wilt u weten hoe wij kunnen ondersteunen bij het opzetten en uitvoeren van uw usability engineering studies? Neem eens een kijkje op de website van Panton voor inspirerende voorbeelden of neem contact op met Céline Joosten.


De wereld van medische wet-en-regelgeving is ingewikkeld en kan voor een nieuwkomer een kluwen van informatie en documenten zijn. Onze trainingen Fundamentals of Medical Device Development en CE-certificering van je (IVD) medical device, helpen daar wegwijs in worden.
In onze training Fundamentals of Medical Device Development nemen we klanten in drie dagen mee door het ontwikkel process van een medical device. Binnen Holland Innovative geloven we dat de combinatie van kennis over wet-en-regelgeving, statistisch onderbouwde design keuzes (design for six sigma) en projectmanagement de schakel is naar snel en betrouwbaar productontwikkeling. Met één dag gewijd aan ieder onderwerp biedt de FMDD je een goede basis om te beginnen met medisch productontwerp.
De training CE-certificering van je (IVD) medical device geeft in 1 dag een overzicht van alle grote onderwerpen van medische wet-en-regelgeving. MDR/IVDR, kwaliteitsmanagement, risicoanalyse en het opzetten van een technisch dossier worden in vogelvlucht besproken, afgewisseld met oefeningen om de theorie inzichtelijk te maken.
Benieuwd naar onze trainingen? Neem eens een kijkje op onze Academy website of neem contact op met Irene van den Graven

